식품의약품안전처, 의약품 개발 관련 최신 상담사례 안내2024.10.18 식품의약품안전처
식품의약품안전처, 의약품 개발 관련 최신 상담사례 안내 – (의약/바이오) 신기술, 신개념 의약품의 품질, 비임상 및 임상시험 관련 고려사항 안내 – (의료/바이오) 기기) 사용성 평가, 임상시험 상담사례 등 기술문서 안내

식품의약품안전처(장관 오유경)는 기업이 의약품·바이오의약품·의료기기 등의 사업화 시 시행착오를 줄이고, 신속한 상용화를 돕기 위해 ‘의약품 개발 상담사례집’을 개정·배포한다고 18일 밝혔다. 의약품, 바이오의약품, 의료기기를 개발하고 있습니다. 본 상담 사례집에는 지난 1년간의 상담 내용이 포함되어 있으며, ❶ 제약바이오 분야 128건(품질 33/비임상시험 65(약리학 27, 독성 38)/임상시험 30), 바이오의약품 151건(품질 58)/비 -임상시험 67건(약리학 21건, 독성 46건)/임상시험 26건), ❷의료기기 분야 기술문서 23건, 임상시험(통계포함) 상담사례 20건이 포함되어 있습니다.

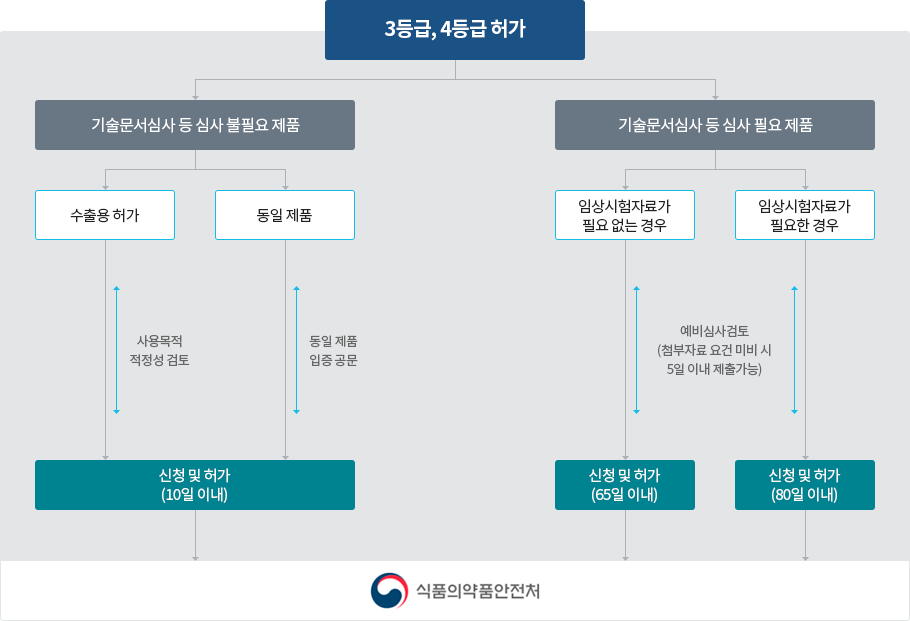
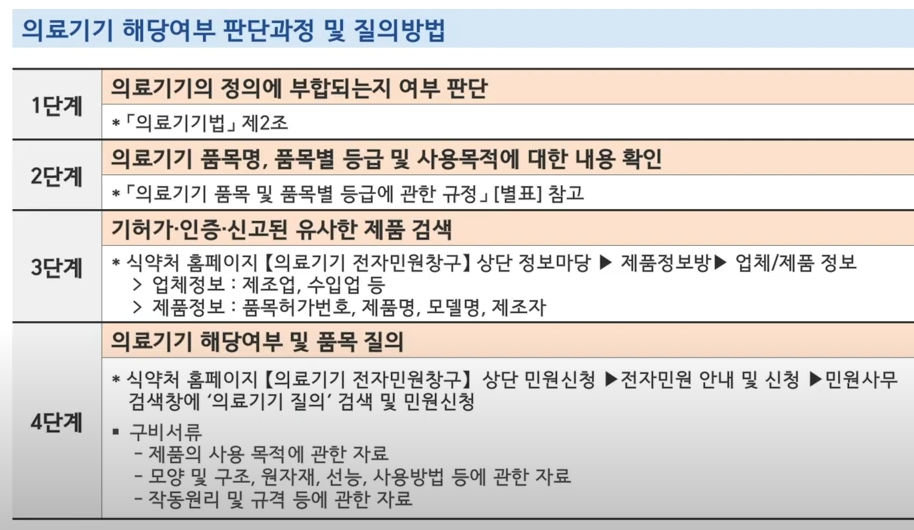
❶ 의약품 및 바이오의약품 분야에서는 ▲합성올리고뉴클레오티드 ▲나노의약품 ▲이중항체 ▲중증열성혈소판감소증 등 신기술 및 신개념 의약품 개발 시 품질, 비임상, 임상 분야별로 고려해야 할 사항을 설명한다. ❷ 의료기기 분야에서는 ▲’위치선정 카테터 제어장치’ 사용 적합성 평가, ▲임상시험 대조군 설정 시 고려사항 등 기술문서와 임상시험 상담 사례를 제공했다. ‘심리치료 뇌전기자극장치’입니다. 식품의약품안전처는 이번 사례집 개정이 업계의 의약품 개발 애로사항을 해결하는 데 실질적인 도움이 될 것으로 기대하며, 앞으로도 의약품 연구개발부터 허가까지 각 단계에서 맞춤형 컨설팅을 제공해 적극 지원할 계획이다. 빠른 상용화. . ‘의약품 개발 상담사례집’은 식품의약품안전처 홈페이지(http://mfds.go.kr) > 법령/자료 > 자료수집 > 안내/지침에서 보실 수 있습니다.